Американские химики в ходе экспериментов с пептидами обнаружили новое объяснение гомохиральности молекул, из которых строится жизнь. Оно основано на дисбалансе односторонних молекул в исходном составе.

Биологические молекулы в большинстве своем хиральны — то есть у них есть зеркальная копия, как у левой ладони есть копия в виде правой. Такие пары существуют в виде энантиомеров, то есть стереоизомеров, устроенных одинаково, но не совмещающихся в пространстве. Однако у молекул, из которых строится жизнь, по неизвестной причине нет хиральных дубликатов. Эту характерную черту называют гомохиральностью или хиральной чистотой. Если в обычных химических реакциях две смеси с лево- или правосторонними молекулами (рацемические смеси) в целом идентичны, то в биологических — наоборот. Смесь из молекул с измененной конфигурацией будет инертна или вовсе токсична, то есть останется «неживой».
Ученые давно пытаются понять, почему молекулы жизни — аминокислоты, углеводы, пептиды — почти всегда встречаются только в односторонней форме. Структуры ДНК и РНК, а также белки построены из молекул, у которых нет пары стереоизомеров: только левовращательные L-аминокислоты и правовращательные D-нуклеотиды. Сами ДНК закручены только в левую сторону. Предполагали, что гомохиральность зависит от разницы физических свойств молекул. Также высказывалась версия, что все дело в случайном нарушении синтеза исходных для молекул веществ.
Новое исследование, опубликованное в журнале Nature, предлагает другое объяснение этой загадки. Химики из американского исследовательского центра The Scripps Research Institute синтезировали наборы пептидов и рассмотрели механизмы хирального усиления в гомохиральном и гетерохиральном реагентах.
Сначала исследователи создали дипептидный продукт, то есть соединили две разные аминокислоты при помощи добавления в раствор тиола (по-другому реакция называется лигированием). Авторы не изобрели эту реакцию, но впервые рассмотрели ее с точки зрения возникновения гомохиральности.
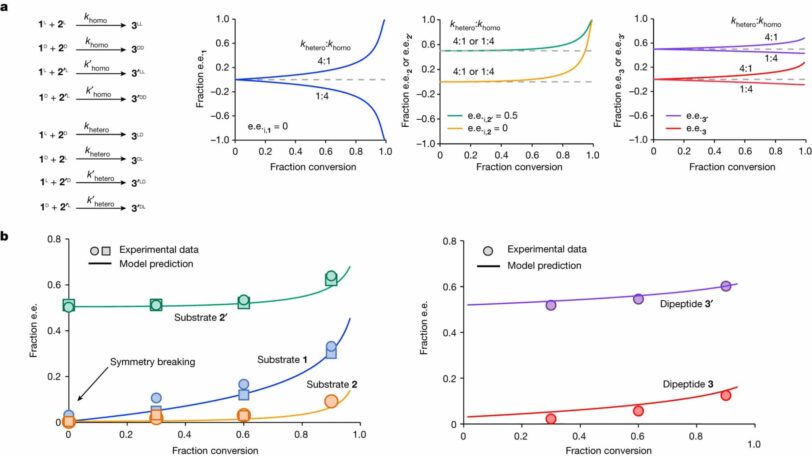
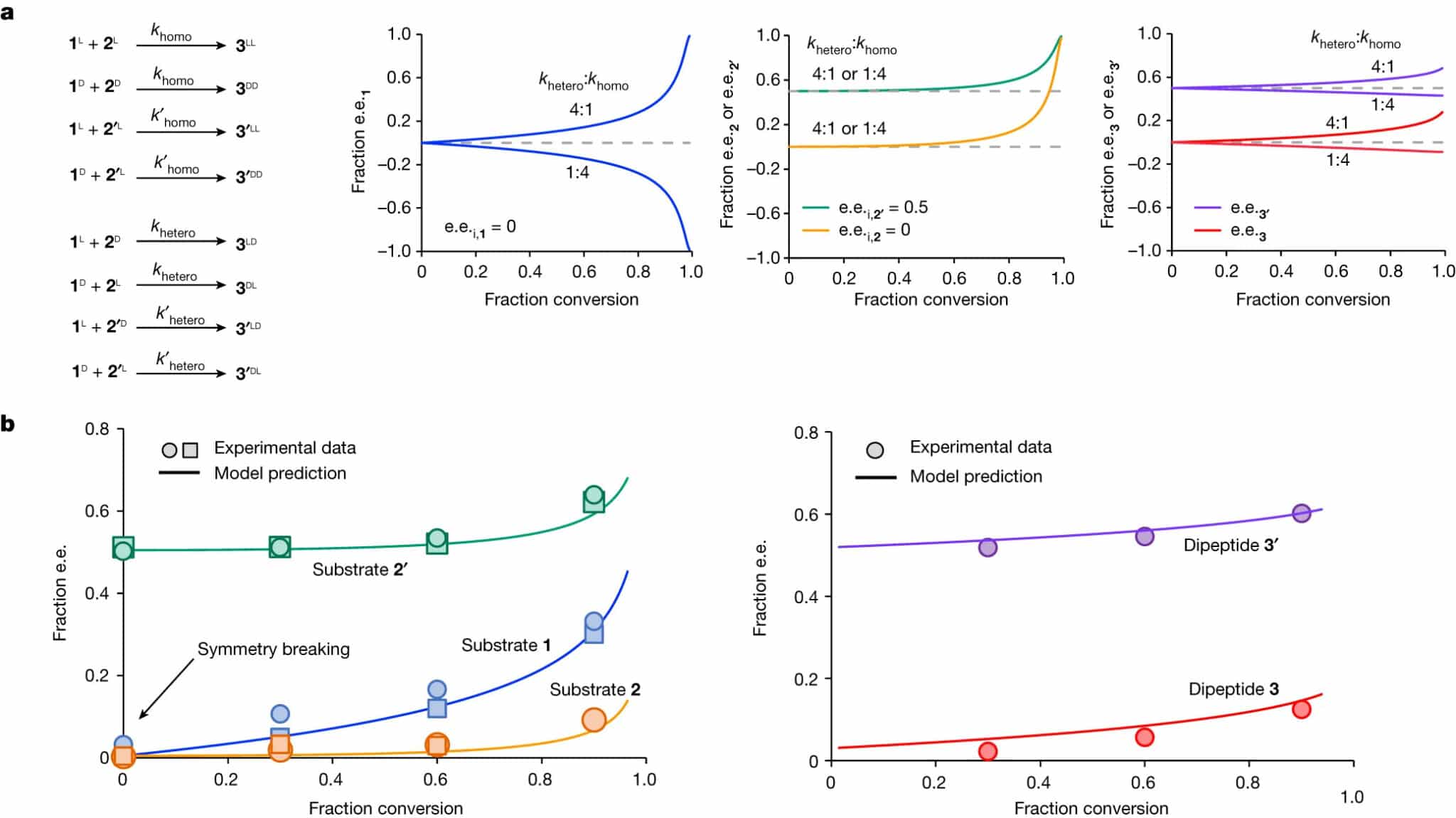
В ходе эксперимента выяснилось, что если в процессе образования дипептида в смеси наблюдался дисбаланс энантиомеров в левую сторону, то симметрия нарушалась и молекулы, количество молекул, закрученных налево, доминировало.
Иными словами, если в исходном субстрате левосторонних аминокислот будет чуть больше, то высокая скорость реакции соединения левосторонних аминокислот с правосторонними быстро истощит правосторонние. Вследствие этого растет концентрация левосторонних молекул.
Вдобавок гетерохиральные пептиды слипались и выпадали в осадок, оставляя в смеси только гомохиральные L-аминокислоты. Самое удивительное, по словам авторов, что добавление ахирального катализатора (то есть молекул тиола, которые могут совмещаться) вызвала ту же селективность пептидов в реакции, что и левосторонний катализатор. Как отмечают исследователи, этот факт делает такую систему возникновения гомохиральности в пребиотических условиях более вероятной.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl + Enter.